Galicia. Examen PAU resuelto de Química. Junio 2014
|
OPCIÓN A |
1.
1.1. Dados los siguientes elementos B, O, C y F, ordénalos en orden creciente según el primer potencial de ionización. Razone l a respuesta.
1.2. Agrupe las especies que son isoelectrónicas: ![]() . Razone la respuesta.
. Razone la respuesta.
1.1. El potencial de ionización es la energía que hay que suministrar a un átomo neutro, gaseoso y en estado fundamental, para arrancarle el electrón más débilmente retenido, es decir, el último. Habrá que suministrar menos energía, por lo tanto, a aquel electrón que se encuentre más lejos del núcleo, puesto que estará menos atraído por éste. Llegamos entonces a la conclusión que cuánto más grande sea el átomo, menos energía necesitaremos y por consiguiente tendrá un menor potencial de ionización. Como todos los elementos mencionados pertenecen al mismo período, el de mayor radio es el que se encuentra más a la izquierda y el de menor radio el que está más a la derecha. Ordenados, entonces, de mayor a menor radio y de menor energía de ionización a mayor quedarían así:
![]()
1.2. Dos especies son isoelectrónicas si tienen el mismo número de electrones. Vamos por lo tanto a hacer las configuraciones electrónicas:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Son especies isoelectrónicas entre sí el ![]() , el
, el ![]() y el
y el ![]() (10 electrones), también el
(10 electrones), también el ![]() y el
y el ![]() (6 electrones) y por último el
(6 electrones) y por último el ![]() y el
y el ![]() (30 electrones).
(30 electrones).
2.
2.1. Formule: benceno, etanoato de metilo, 2-butanol y nombre: CH3-CH2-CH2-CHO y CH3-O-CH3.
2.2. Razone el tipo de isomería que presenta el compuesto 2-hidroxipropanoico, de fórmula química: CH3-CH(OH)-COOH. Señale e indique el nombre de los grupos funcionales que presenta.
2.1. Formulamos los compuestos indicados:
.png)
Nombrar:
CH3-CH2-CH2-CHO : butanal
CH3-O-CH3 : dimetiléter
2.2. El compuesto ácido 2-hidroxipropanoico presenta isomería óptica, ya que tiene un carbono asimétrico o quiral, es decir, unido a cuatro sustituyentes distintos:
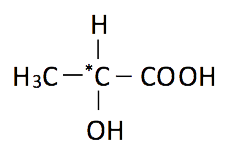
Presenta dos grupos funcionales, el principal, el ácido carboxílico (-COOH) y el grupo alcohol (-OH).

