Galicia. Examen PAU resuelto de Química. Junio 2014
|
OPCIÓN B |
3. En el laboratorio se puede preparar cloro gas haciendo reaccionar permanganato de potasio sólido con ácido clorhídrico concentrado.
3.1. En el transcurso de esta reacción redox se forma cloro, cloruro de manganeso (II), cloruro de potasio y agua. Escriba y ajuste la reacción molecular mediante el método del ión-electrón.
3.2. Calcule el volumen de cloro gas, a 20 0C y 1 atm (101,3 kPa), que se obtiene al hacer reaccionar 10 mL de ácido clorhídrico concentrado del 35,2% en masa y densidad 1,175 g/mL con un exceso de permanganato de potasio.
DATOS: ![]() ó
ó ![]()
3.1. La reacción que hay que ajustar es:
![]()
El manganeso se reduce, pasa de ![]() a
a ![]() y el cloro se oxida, pasa de
y el cloro se oxida, pasa de ![]() a
a ![]() . Las semireacciones y la reacción global serían:
. Las semireacciones y la reacción global serían:
.png)
Por lo tanto, la reacción ajustada queda así:
![]()
3.2. La reacción y los datos que nos dan son:
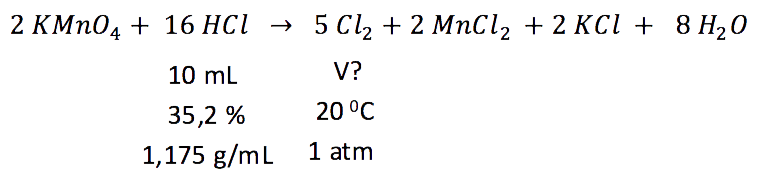
A partir de los datos del ácido clorhídrico calculamos los moles de cloro:
![]()
![]()
Con los moles de ácido clorhídrico calculados y con la ecuación de los gases ideales calculamos el volumen de cloro gas:
.png)
![]()

