Galicia. Examen PAU resuelto de Química. Junio 2014
|
OPCIÓN B |
1.
1.1. Considere el siguiente proceso en equilibrio: ![]() . Razone que le ocurre al equilibrio si se disminuyen la presión de la mezcla de reacción a temperatura constante.
. Razone que le ocurre al equilibrio si se disminuyen la presión de la mezcla de reacción a temperatura constante.
1.2. Especifique qué orbitales híbridos utiliza el carbono en el eteno (C2H4), así como el tipo de enlaces que se forman en la molécula. Razone la respuesta.
1.1. Para ver lo que ocurre con el equilibrio cuando variamos alguna de las condiciones del mismo vamos a basarnos en el principio de Le Chatelier, que dice que si en un sistema en equilibrio modificamos la presión, la temperatura, la concentración, etc., el sistema evolucionará en el sentido que tienda a oponerse a dicha modificación.
El hecho de disminuir la presión de la mezcla es el mismo que el de aumentar el volumen del recipiente. Al hacerlo ocurre lo siguiente con la constante de equilibrio:
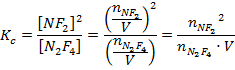
Como se ve en la expresión de la constante, al aumentar el volumen disminuye el valor de Kc, por lo tanto el equilibrio se desplaza hacia la derecha, para aumentar la concentración de NF2 y disminuir la de N2F4 y restablecer así el valor de la constante.
1.2. La configuración electrónica del carbono es la siguiente:
![]()
Como vemos el carbono tiene 4 electrones de valencia y forma cuatro enlaces. Lo que hace es promocionar un electrón del orbital 2s al orbital 2p, para tener los cuatro electrones desapareados y poder así formar esos cuatro enlaces.
El eteno (H2C=CH2) forma un doble enlace entre carbonos. Uno de eses enlaces es ![]() y el otro es un enlace
y el otro es un enlace ![]() . Éste último es un enlace lateral que se forma con los orbitales p de los carbonos. El resto de enlaces que forman son todos frontales o
. Éste último es un enlace lateral que se forma con los orbitales p de los carbonos. El resto de enlaces que forman son todos frontales o ![]() y se forman con orbitales híbridos. Por lo tanto llegamos a la conclusión de que cada carbono hibrida un orbital s y dos orbitales p, por lo tanto tiene hibridación
y se forman con orbitales híbridos. Por lo tanto llegamos a la conclusión de que cada carbono hibrida un orbital s y dos orbitales p, por lo tanto tiene hibridación ![]() . La molécula sería así:
. La molécula sería así:
.png)
2. Justifique si estas afirmaciones son correctas:
2.1. El producto de la constante de ionización de un ácido y la constante de ionización de su base conjugada es igual a la constante del producto iónico del agua.
2.2. La presencia de un ión común disminuye la solubilidad de una sal ligeramente soluble.
2.1. Esta afirmación es verdadera.
Supongamos el equilibrio de ionización de un ácido débil cualquiera y su constante de acidez:
![]()
Y ahora el equilibrio de ionización de la base conjugada del equilibrio anterior:
![]()
Si multiplicamos las dos constantes obtenemos el producto iónico del agua:
![]()
2.2. También es verdadera.
Supongamos el siguiente equilibrio de una sal poco soluble:
![]()
Tenemos en equilibrio los iones en disolución con el precipitado sólido (AB). Si ahora añadimos un ión común, bien ![]() , o
, o ![]() , aplicando la Ley de Le Chatelier, el equilibrio se desplazará hacia la izquierda, lo que provoca que aumente la cantidad de precipitado y por consiguiente que disminuya la cantidad de esa sal que tenemos disuelta, es decir, que la solubilidad de la sal disminuye.
, aplicando la Ley de Le Chatelier, el equilibrio se desplazará hacia la izquierda, lo que provoca que aumente la cantidad de precipitado y por consiguiente que disminuya la cantidad de esa sal que tenemos disuelta, es decir, que la solubilidad de la sal disminuye.

