Oxidación con permanganato
8. Por oxidación del ion bromuro con el ion permanganato en medio ácido, se obtiene bromo y una sal de manganeso (II):
a) Escribe la reacción iónica y ajústala por el método del ion-electrón.
b) Calcula cuántos gramos de permanganato de potasio pueden ser reducidos, por 250 mL de una disolución 0,1 M de bromuro de potasio, a la sal de manganeso (II).
a) La reacción iónica que tenemos que ajustar es la siguiente:
![]()
En este caso, el manganeso se reduce, puesto que pasa de estado de oxidación ![]() a
a ![]() . La semirreacción ajustada sería:
. La semirreacción ajustada sería:
![]()
La especie que se oxida es el bromo. La semirreacción de reducción ajustada quedaría:
![]()
Multiplicamos las semirreacciones para poder simplificar los electrones y obtenemos la reacción global ajustada:
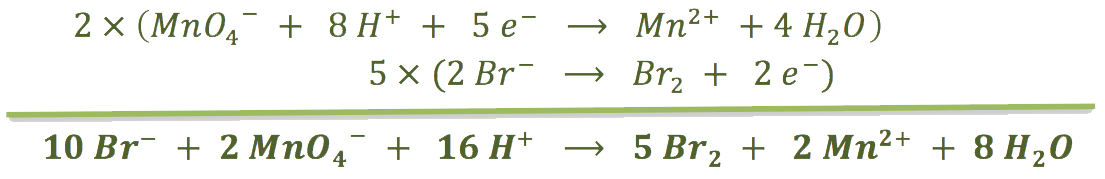
b) Nos pide los gramos de permanganato que se pueden reducir con una determinada cantidad de bromuro de potasio:
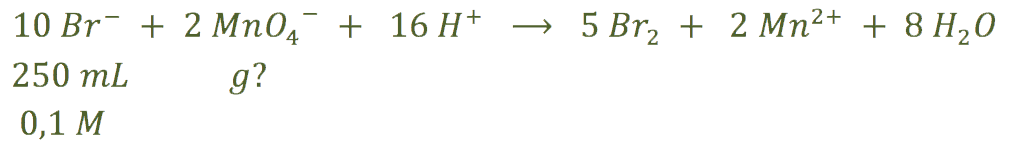
A partir de la concentración y del volumen de disolución de bromuro de potasio:
![]()
A partir de estos moles calculamos los moles de permanganato de potasio y los pasamos a gramos:
![]()
![]()

