Estequiometría con reacción redox
7. El ácido nítrico concentrado reacciona con el cobre para formar nitrato de cobre (II), dióxido de nitrógeno y agua:
a) Escribe la reacción ajustada.
b) ¿Cuántos mililitros de ácido nítrico, del 95% de pureza y densidad 1,5 g/mL, son necesarios para que reaccione totalmente 3,4 g de cobre?
c) ¿Qué volumen de dióxido de nitrógeno se formará, medido a 29 0C de temperatura y 748 mmHg de presión?
a) La reacción que tenemos que ajustar es la siguiente:
![]()
Como siempre, para ajustar la reacción por el método del ion-electrón, empezamos poniendo los números de oxidación de cada especie:
|
![]()
El nitrógeno se reduce, pasa de estado de oxidación ![]() a
a ![]() . La semirreacción de reducción será:
. La semirreacción de reducción será:
![]()
Ajustamos la semirreacción en átomos y en carga:
![]()
La especie que se oxida es el cobre, pasa de estado de oxidación ![]() a
a ![]() . La semirreacción de oxidación será:
. La semirreacción de oxidación será:
![]()
Ajustamos en carga, puesto que en átomos ya está ajustada:
![]()
Multiplicamos por dos la primera semirreacción y obtenemos la reacción iónica global:

Eliminamos los electrones y a partir de la reacción iónica escribimos la molecular:
![]()
Como cada anión nitrato necesita un protón y tenemos dos aniones nitrato y cuatro protones, tenemos un exceso de estos últimos. De todos modos, se formarán cuatro moléculas de ácido nítrico, porque parte de los nitrógenos del ácido se reducen (los que forman parte del dióxido de nitrógeno) y la otra parte (los que forman parte del nitrato de cobre) quedan igual, no se oxidan ni se reducen.
b) Ahora nos preguntan qué volumen de ácido nítrico necesitamos para que reaccione con 3,4 g de cobre:
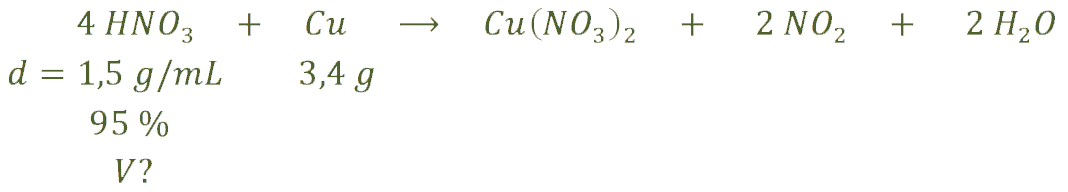
Pasamos a moles los gramos de cobre y a partir de los mismos, y con el ajuste, calculamos los moles que necesitamos de ácido nítrico:
![]()
![]()
Pasamos los moles de ácido nítrico a gramos:
![]()
![]()
Estos son los gramos puros que necesitamos de ácido nítrico, pero como nosotros vamos a usar una disolución que está al 95%, de cada 100 g de esa disolución sólo llevamos 95 g de ácido nítrico. Por lo que debemos calcular cuántos gramos necesitamos de esa disolución:
![]()
Por último, sólo nos queda calcular qué volumen de disolución necesitamos. Lo hacemos a partir de la densidad:
![]()
c) Ahora nos piden el volumen de dióxido de nitrógeno que ser forma:
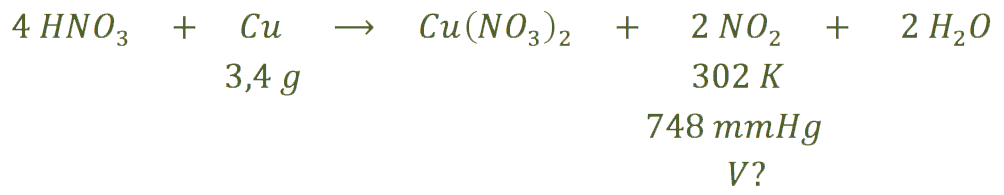
A partir de los gramos de cobre, calculamos los moles de este metal y con ellos hallamos los moles que se obtendrían de dióxido de nitrógeno:
![]()
![]()
Ahora, utilizando la ecuación de los gases ideales y pasando previamente la presión a atmósferas y la temperatura a Kelvin, calculamos el volumen de gas que se obtiene:
![]()
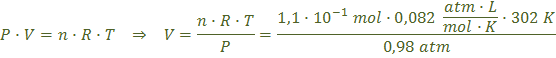
![]()

