Reacción entre el estaño y el ácido nítrico concentrado
13. El estaño metálico reacciona con el ácido nítrico concentrado y forma óxido de estaño (IV), dióxido de nitrógeno y agua.
a) Ajusta la reacción por el método del ion-electrón.
b) Calcula el volumen de una disolución de ácido nítrico del 16,0% en masa y densidad 1,09 g/mL que reaccionará estequiométricamente con 2,0 g de estaño.
a) La reacción que tenemos que ajustar es:
![]()
En este caso, el nitrógeno se reduce, puesto que pasa de estado de oxidación ![]() a
a ![]() . La semirreacción ajustada sería:
. La semirreacción ajustada sería:
![]()
La especie que se oxida es el estaño, pasando de ![]() a
a ![]() de número de oxidación. La semirreacción de reducción ajustada quedaría:
de número de oxidación. La semirreacción de reducción ajustada quedaría:
![]()
Multiplicamos la primera semirreacción para poder simplificar los electrones y obtenemos la reacción global ajustada. También simplificamos las moléculas de agua y los protones:
.png)
A partir de la ecuación iónica escribimos la molecular:
![]()
b) Los datos que nos da el problema para poder calcular el volumen de la disolución de ácido nítrico son:
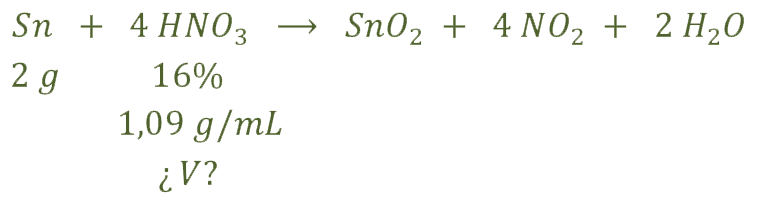
Calculamos los moles de estaño y a partir de los mismos y, con el ajuste de la reacción, obtenemos los de ácido nítrico:
![]()
![]()
Pasamos los moles de ácido nítrico a gramos:
![]()
![]()
Con los gramos de ácido nítrico calculados y sabiendo que la disolución contiene un 16% de ácido, podemos calcular los gramos de la disolución:
![]()
Para terminar, calculamos el volumen a partir de la densidad de la disolución:
![]()

