Reacción de hierro (II) con dicromato de potasio
10. De 1 L de una disolución acuosa de cloruro de hierro (II) se toman 100 mL y se hacen reaccionar, en medio ácido, con una disolución 0,35 M de dicromato de potasio, siendo necesarios 64,4 mL de esta última para completar la oxidación. Sabiendo que en esta reacción el hierro (II) y el ion dicromato se reduce a cromo (III):
a) Formula y ajusta, por el método del ion-electrón, la ecuación de la reacción.
b) Calcula la molaridad de la disolución de cloruro de hierro (II)
a) La reacción que tenemos que ajustar es la siguiente:
![]()
En este caso, el cromo se reduce, puesto que pasa de estado de oxidación ![]() a
a ![]() . La semirreacción ajustada sería:
. La semirreacción ajustada sería:
![]()
La especie que se oxida es el hierro, pasando de a de número de oxidación. La semirreacción de reducción ajustada quedaría:
![]()
Multiplicamos la semirreacción del hierro para poder simplificar los electrones y obtenemos la reacción global ajustada:
.png)
Obtenemos la ecuación molecular a partir de la iónica, añadiendo los elementos que actuaron como espectadores. Tendremos en cuenta que en los productos tendremos los iones cloruro que acompañaban el hierro en los reactivos y como medio ácido vamos a poner ácido clorhídrico, en el que también tenemos esos iones:
![]()
b) Los datos que nos da el problema son los siguientes:
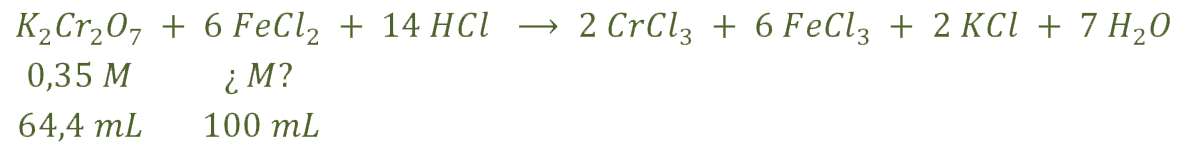
Calculamos los moles de dicromato de potasio:
![]()
Ahora, a partir del ajuste de la reacción calculamos los moles que se obtienen de cloruro de hierro:
![]()
Sabiendo los moles y el volumen de cloruro de hierro podemos calcular la concentración de la disolución:
![]()

