Concentraciones en equilibrio
6. Una mezcla gaseosa de 1 L, constituida inicialmente por 7,94 moles de hidrógeno y 5,30 moles de yodo, se calienta a 445 0C, con lo que se forman en el equilibrio 9,52 moles de yoduro de hidrógeno, según la reacción: ![]() .
.
a) Calcula razonadamente el valor de la constante de equilibrio a dicha temperatura.
b) Si hubiésemos partido de 4 moles de hidrógeno gas y 2 moles de yodo gas, ¿cuántos moles de yoduro de hidrógeno habría en el equilibrio?
a) En el equilibrio tendremos:
.png)
Como el enunciado nos dice que en equilibrio hay 9,52 moles de yoduro de hidrógeno, podemos calcular los moles que reaccionan:
![]()
Ahora planteamos la expresión de la constante de equilibrio, substituimos los datos y calculamos Kc:
.png)
![]()
b) En este caso el equilibrio que tendríamos es el siguiente:
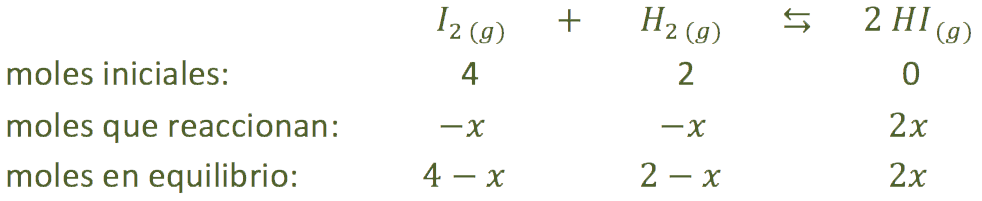
Utilizando el valor de la constante calculada en el apartado anterior, podemos calcular los moles que reaccionan:
.png)
![]()
![]()
De los dos resultados obtenidos sólo nos vale el primero, puesto que el segundo si lo substituimos en los moles en equilibrio haría que obtuviésemos valores negativos para el hidrógeno y para el yodo. Por lo tanto, con el primer resultado calculamos los moles de yoduro de hidrógeno en el equilibrio:
![]()

