Grado de disociación
12. La ![]() , a 1.273 K, para la reacción:
, a 1.273 K, para la reacción: ![]() es 1.455,6. Un matraz de 2 dm3 se llena de monóxido de nitrógeno en condiciones normales. Se cierra y se calienta hasta alcanzar la temperatura de 1.273 K, llegando a un estado de equilibrio. Calcula:
es 1.455,6. Un matraz de 2 dm3 se llena de monóxido de nitrógeno en condiciones normales. Se cierra y se calienta hasta alcanzar la temperatura de 1.273 K, llegando a un estado de equilibrio. Calcula:
a) Composición de la mezcla en equilibrio.
b) Grado de disociación del monóxido de nitrógeno a esa temperatura.
c) Presión en el interior del recipiente durante el equilibrio a esa temperatura.
a) Si llenamos un matraz de 2 L de monóxido de nitrógeno en condiciones normales (P = 1 atm ; Tª = 273 K), con la ecuación de los gases ideales podemos calcular los moles iniciales que se pusieron de este gas:
![]()
![]()
.png)
A partir del valor de Kp podemos calcular el de Kc utilizando la fórmula deducida en la resolución del ejercicio nº 3:
![]()
A partir del ajuste de la reacción, calculamos el incremento de moles, como los moles en fase gas en productos menos los moles en fase gas en los reactivos:
![]()
Como el incremento de moles es cero, el valor de Kc es igual al de Kp:
![]()
El equilibrio nos quedará:
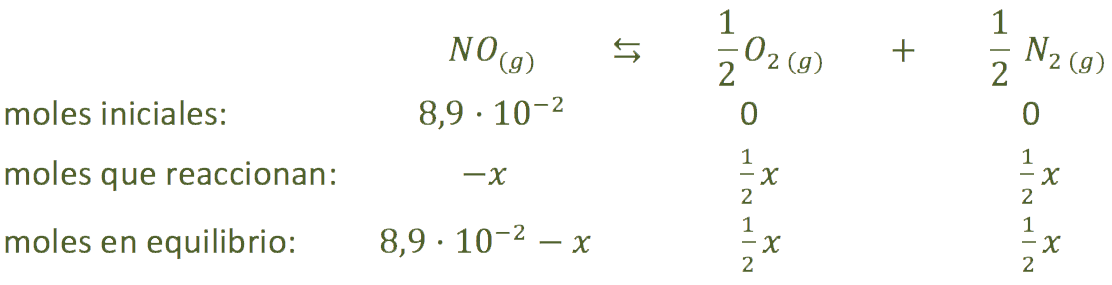
La constante de equilibrio será:
![]()
Sustituyendo todos los datos podemos calcular los moles que reaccionan:
.png)
![]()
Como vemos la cantidad disociada es prácticamente igual a la inicial, por lo que la cantidad de monóxido de nitrógeno que queda en equilibrio es prácticamente nula. Así entonces, los moles en equilibrio serán:
![]()
![]()
b) Si comentamos en el apartado anterior que el monóxido de nitrógeno está totalmente disociado, el porcentaje de disociación será del 100%:
![]()
c) Podemos calcular los moles totales en equilibrio, que serán:
![]()
Sabiendo estos moles y las condiciones de equilibrio, calculamos la presión total del mismo con la ecuación de los gases ideales:
![]()
![]()
.png)

