Estructuras de Lewis de iones
12. Escribe las estructuras de Lewis de los siguientes compuestos e iones: monocloruro de yodo, peróxido de hidrógeno, ion hidroxilo, ion oxonio, ion hidrogenosulfuro, fosfina, ion fosfonio, tetrafluoruro de silicio y cianógeno ![]() .
.
Para hacer la estructura de Lewis de los compuestos que nos dicen procederemos de la misma manera que en los dos ejercicios anteriores. Empezamos por el monocloruro de yodo:
![]()
![]()
![]()
![]()
![]()
.png)
Hacemos ahora la estructura del peróxido de hidrógeno:
![]()
![]()
![]()
![]()
.png)
El siguiente es un ion negativo, el anión hidroxilo. Cuando tenemos un anión debemos sumar un electrón, debido a la carga negativa, a los electrones que ya tienen los átomos que forman parte de la molécula. Por el resto procedemos igual que antes:
![]()
![]()
![]()
![]()
En los iones para representar la molécula, se suele poner ésta entre corchetes y ponemos fuera la carga:
.png)
Ahora como el ion oxonio es un catión, tiene carga positiva, debemos restar un electrón al número total que tienen los átomos de la molécula:
![]()
![]()
![]()
![]()
Cabe destacar que esta molécula tiene un enlace covalente dativo (el enlace indicado con una flecha), porque todos los enlaces están formados por un electrón de cada uno de los átomos, pero ese está formado con dos electrones que pertenecen al oxígeno:
.png)
Hacemos ahora la estructura del ion hidrogenosulfuro:
![]()
![]()
![]()
![]()
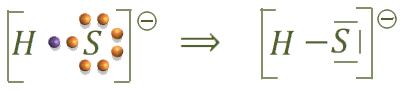
La estructura de la fosfina sería:
![]()
![]()
![]()
![]()
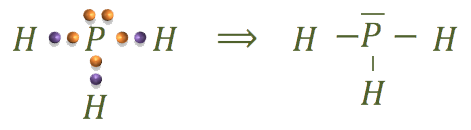
La estructura del catión fosfonio es:
![]()
![]()
![]()
![]()
En este caso sucede lo mismo que con el ion oxonio, tenemos un enlace covalente dativo, ya que el par de electrones de ese enlace los pone el fósforo:
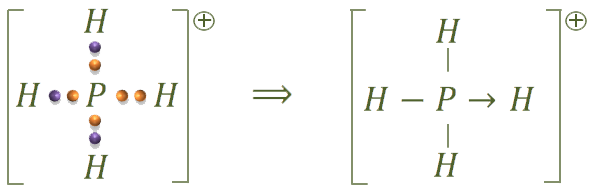
La estructura del tetrafluoruro de silicio es:
![]()
![]()
![]()
![]()
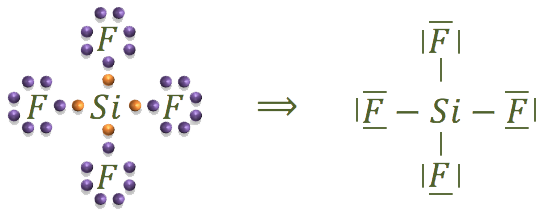
El último de los compuestos es el cianógeno:
![]()
![]()
![]()
![]()
![]()

