Combustión de mezcla de hidrocarburos
42. Un recipiente cerrado de 5 dm3 contiene 0,05 moles de metano, 0,01 moles de etano, 0,01 moles de helio y 0,14 moles de oxígeno a la temperatura de 0 0C.
a) Calcula la composición de la mezcla en % en masa y en volumen.
b) Si se hace saltar una chispa, el metano y el etano reaccionan y se obtiene dióxido de carbono y agua. Calcula las presiones parciales de dióxido de carbono y del oxígeno en la mezcla gaseosa final cuando la temperatura es de 150 0C.
a) Para calcular el porcentaje en masa necesitamos los gramos de cada gas:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
La masa total de gas que tenemos es:
![]()
Ahora calculamos el porcentaje en masa de cada gas:
![]()
![]()
![]()
![]()
El tanto por ciento en volumen, se puede calcular con los moles, porque sabemos que en las mismas condiciones de presión y temperatura la misma cantidad de moles de gases distintos ocupan el mismo volumen. Es entonces los mismo que calcular la fracción molar de cada gas y multiplicarla por cien:
![]()
![]()
![]()
![]()
![]()
b) Al hacer saltar la chispa, el helio no reacciona, el metano y el etano reaccionan con el oxígeno produciendo dióxido de carbono y agua. Necesitamos calcular los moles de oxígeno que quedan sin reaccionar y los moles de dióxido de carbono y de agua que se producen en las dos reacciones siguientes:
.png)
![]()
![]()
![]()
.png)
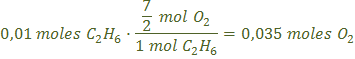
![]()
![]()
Los moles de todos los gases después de la combustión son:
![]()
![]()
![]()
![]()
![]()
Ahora vamos calcular la presión total, con los moles totales:
![]()
![]()
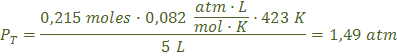
Ahora aplicando la ley de Dalton, de las presiones parciales, calculamos la presión parcial del dióxido de carbono y del oxígeno:
![]()
![]()

