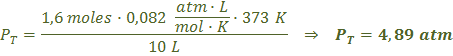Ejercicio resuelto de gases ideales
33. En un matraz de 10 L se introducen 2,0 g de hidrógeno, 8,4 g de nitrógeno y 4,8 g de metano a 25 0C. Calcula:
a) La fracción molar de cada gas.
b) La presión parcial de cada uno.
c) La presión total de la mezcla cuando se eleva la temperatura a 100 0C.
a) Para calcular la fracción molar debemos, primero, calcular cuántos moles tenemos de cada gas:
![]()
![]()
![]()
![]()
![]()
![]()
Con estos datos ya podemos calcular la fracción molar:
![]()
![]()
![]()
b) Para calcular las presiones parciales utilizamos la ley de Dalton, pero primero tenemos que calcular la presión total. Utilizamos para ello la ley de los gases ideales:
![]()
.png)
Ahora calculamos las presiones parciales:
![]()
![]()
![]()
c) Si se eleva la temperatura a 100 0C (373 K), los moles y el volumen del recipiente no varían, por lo tanto la presión será:
![]()