Ley de Hess
22. Responde de forma razonada:
a) Enuncia la ley de Hess. ¿Qué aplicación tiene esta ley?
b) Al decir que una reacción A es más exotérmica que otra B, ¿significa que las entalpías de formación de los productos finales son en el caso A más negativas que en el B?
23. Determina la entalpía de la reacción de descomposición del agua oxigenada:
![]()
a partir de las siguientes reacciones:
![]()
![]()
24. Calcula el calor de formación del óxido de cinc a partir de los siguientes datos:
![]()
![]()
![]()
25. Calcula la entalpía de la reacción de fermentación alcohólica:
![]()
a partir de las siguientes ecuaciones termoquímicas:
![]()
![]()
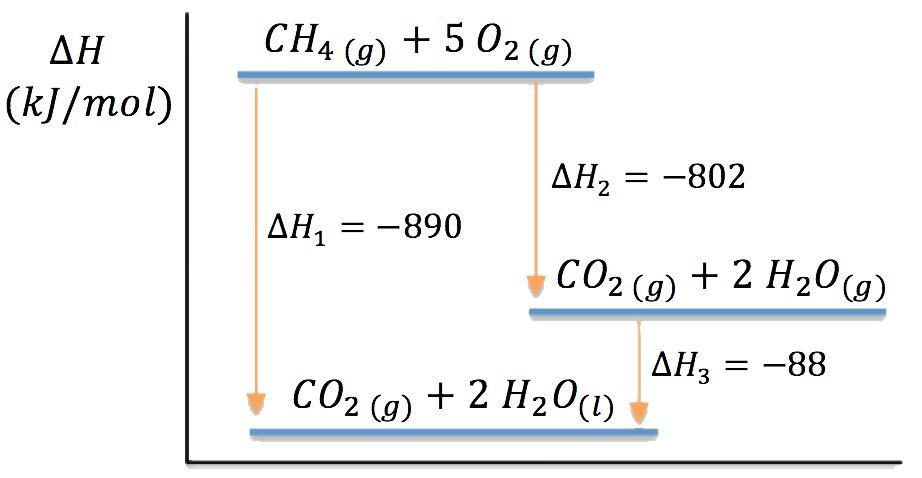
26. Escribe las ecuaciones termoquímicas representadas en el diagrama entálpico y deduce la variación de entalpía para la siguiente transformación: ![]() .
.
27. El escarabajo bombardero, cuando se ve amenazado, arroja un espray químico formado por una mezcla de hidroquinona y peróxido de hidrógeno. Estos reaccionan según la ecuación:
![]()
Halla la entalpía de esta reacción a partir de la siguiente información:
![]()
![]()
![]()
28. Los valores de las entalpías estándar de combustión del carbono (s) y del benceno (l) son, respectivamente, ![]() 393,7 kJ/mol y
393,7 kJ/mol y ![]() 3267 kJ/mol, y el valor de la entalpía estándar de formación para el agua líquida es
3267 kJ/mol, y el valor de la entalpía estándar de formación para el agua líquida es ![]() 285,9 kJ/mol.
285,9 kJ/mol.
a) Calcula la entalpía de formación del ![]() .
.
b) ¿Cuántos kJ se desprenderán o absorberán en la combustión de 0,5 kg de benceno?
29. La combustión del acetileno produce dióxido de carbono y agua:
a) Escribe la ecuación química correspondiente al proceso.
b) Calcula el calor molar de combustión del acetileno y el calor producido al quemar 1,00 kg de acetileno.
DATOS: ![]()
![]()

